ИММУНОТОКСИКОЛОГИЯ
Joseph G. Vos, Henk van Loveren
Функции иммунной системы заключаются в защите организма от проникающих извне инфекций и в осуществлении иммунного наблюдения за возникающими опухолевыми клетками. Она имеет первую линию обороны, которая является неспецифической и может самостоятельно инициировать эффекторные реакции, а также приобретенную специфическую ветвь, где лимфоциты и антитела выполняют специфическую роль распознавания и последующей реакции на антиген.
Иммунотоксикология определялась как "дисциплина, изучающая события, которые могут привести к нежелательным эффектам в результате взаимодействия ксенобиотиков с иммунной системой. Эти нежелательные явления могут вызвать последствия (1) прямого и/или косвенного эффекта ксенобиотиков (и/или продуктов его биотрансформации) на иммунную систему, или (2) иммунологически основанную ответную реакцию на соединение и/или его метаболит (ы) либо антигены хозяина, измененные данным соединением или его метаболитами" (Berlin et al. 1987).
В случае, если иммунная система выступает в качестве пассивной мишени для химических веществ, результатом может быть пониженная сопротивляемость инфекции и некоторым формам неоплазии, либо иммунная дисрегуляция/стимуляция, могущие усугубить аллергию или аутоиммунитет. В случае, если иммунная система реагирует на антигенную специфичность ксенобиотика или антиген хозяина, измененные соединением, токсичность может быть выражена в виде аллергии или аутоиммунного заболевания.
Разработаны модели с использованием животных для исследования подавления иммунитета, вызванного химическими веществами, причем достоверность ряда методов подтверждена (Burleson, Munson, and Dean 1995; IPCS 1996). Для целей тестирования используется поэтапный подход, обеспечивающий адекватный выбор из огромного количества имеющихся анализов. В целом, задачей первого этапа является определение потенциальных иммунотоксикантов. Если потенциальные иммунотоксиканты установлены, проводится второй этап анализов для подтверждения и характеризации дальнейших наблюдаемых изменений. Во время третьего этапа непосредственно изучаются механизмы действия соединения. В результате опытов на животных установлено, что ряд ксенобиотиков является иммуноподавителями.
Существует ограниченная база данных о нарушении иммунных функций человека под воздействием химических веществ из окружающей среды (Descotes 1986; NRC Subcommittee on Immunotoxicology 1992). Использование маркеров иммунотоксичности не получило распространения в клинических и эпидемиологических исследованиях воздействия этих химических веществ на здоровье человека. Такие исследования проводились редко, а интерпретация полученных данных не позволяет сделать однозначного вывода вследствие, например, неконтролируемого характера воздействия. Поэтому решения относительно опасности и риска сегодня базируются на оценке иммунотоксичности у грызунов с последующей экстраполяцией на человека.
Реакции гиперчувствительности, в частности, аллергическая астма и контактный дерматит, представляют серьезную проблему охраны труда на производстве в промышленно развитых странах (Vos, Younes and Smith 1995). Явление контактного дерматита было впервые исследовано на морской свинке (Andersen and Maibach 1985). До сегодняшнего дня этот вид животных предпочтительно использовался в опытах с целью прогнозирования. Существуют разнообразные методы тестирования на морских свинках, из них наиболее часто используется тест максимизации и тест Buehler с зарастающей бляшкой. Тесты на морских свинках и новые подходы с использованием мышей, например, тесты на опухолях и локальных лимфатических узлах, обеспечили токсикологов новыми инструментами для оценки опасности сенсибилизации кожи. Ситуация с сенсибилизацией дыхательного тракта резко отличается. Сегодня отсутствуют достаточно обоснованные и широко распространенные методы определения химических аллергенов дыхательных путей, хотя был достигнут определенный прогресс в разработке моделей изучения химической аллергии дыхательных путей на морских свинках и мышах.
Человеческие данные свидетельствуют о том, что химические агенты, в частности, лекарства могут вызывать аутоиммунные заболевания (Kammьller, Bloksma and Seinen 1989). Ряд опытов на животных позволяет моделировать аутоиммунные заболевания. Они охватывают как спонтанную патологию (например, системная красная волчанка на новозеландской черной мыши), так и аутоиммунные явления, вызванные экспериментальной иммунизацией автоантигеном перекрестной реакции (например, артрит, вызванный H37Ra у крыс линии Левис). Эти модели применяются для доклинической оценки иммуноподавляющих лекарств. В очень редких исследованиях рассматривается потенциал этих моделей для оценки роли ксенобиотиков в приобретенном или наследственном аутоиммунитете. Практически отсутствуют модели, основанные на животных, для исследования возможности химических веществ вызывать аутоиммунные заболевания. Одна из моделей, используемая в ограниченном масштабе - это подколенный лимфатический узел у мышей. Как и у человека, у лабораторных животных генетические факторы играют решающую роль в развитии аутоиммунного заболевания (AD), что ограничивает использование этих тестов для прогноза заболевания.
Иммунная система
Главная функция иммунной системы - защита организма от бактерий, вирусов, паразитов, грибов и неопластических клеток. Это обеспечивается благодаря хорошо скоординированным действиям различного вида клеток и их растворимых посредников. Защиту хозяина можно грубо разделить на неспецифическую или врожденную сопротивляемость и специфический или приобретенный иммунитет при посредничестве лимфоцитов (Roitt, Brostoff and Male 1989).
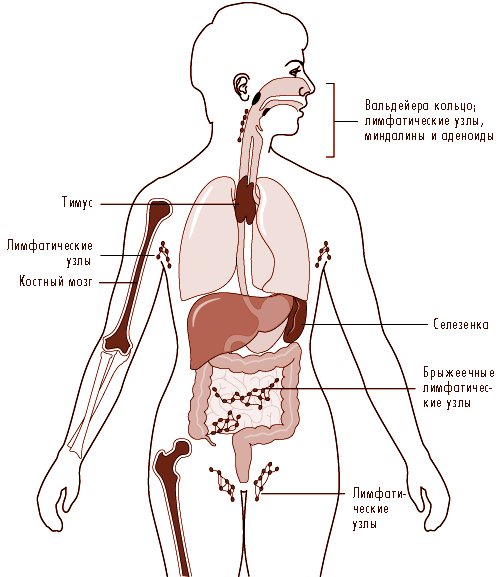
Компоненты иммунной системы присутствуют в различных частях организма (Jones et al. 1990). Компартмент лимфоцита присутствует в лимфатических органах (Рис. 33.14). Костный мозг и тимус классифицируются как первичные или центральные лимфатические органы; вторичные или периферийные лимфатические органы включают лимфатические узлы, селезенку и лимфоидные ткани вдоль секреторной поверхности желудочно-кишечного и дыхательного тракта, так называемые лимфоидные ткани, связанные со слизистой оболочкой (MALT). В них одновременно находится коло половины всех лимфоцитов организма. Кроме того, кожа является важным органом, индуцирующим иммунную реакцию на антигены, присутствующие в коже. Важную роль в этом процессе играет эпидермальные клетки Лангерханса (Langerhans), обладающие антиген-представляющей функцией.
Фагоцитные клетки родословной линии моноцитов/макрофагов, известные как мононуклеарная фагоцитная система (MPS), находятся в лимфатических органах и внеузловых участках; внеузловые фагоциты включают клетки Купфера (Kupffer) в печени, альвеолярных макрофагах в легких, мезангиальных макрофагах в почках и глиальных клетках мозга. Полиморфноядерные лейкоциты (PMN) присутствуют, главным образом, в мозге и костном мозге, но аккумулируются в участках воспаления.
--------------------------------------------------------------------------------
Рис. 33.14 Первичные и вторичные лимфоидные органы и ткани
--------------------------------------------------------------------------------
Неспецифическая защита
Первая линия защиты от микроорганизмов осуществляется такими физическими и химическими барьерами как кожа, дыхательный и пищеварительный тракт. Эти барьеры укрепляется неспецифическими защитными механизмами, включая клетки фагоцитов, такие как макрофаги и полиморфноядерные лейкоциты, способные убивать патогены, а также природные "клетки-убийцы", способные лизировать опухолевые клетки и клетки, зараженные вирусом. Комплементная система и некоторые ингибиторы микробов (например, лизосомы) также участвуют в неспецифической ответной реакции.
Специфический иммунитет![]() Следующая часть документа
Следующая часть документа