Рис. 33.14 Первичные и вторичные лимфоидные органы и ткани
Функции иммунной системы заключаются в защите организма от проникающих извне инфекций и в осуществлении иммунного наблюдения за возникающими опухолевыми клетками. Она имеет первую линию обороны, которая является неспецифической и может самостоятельно инициировать эффекторные реакции, а также приобретенную специфическую ветвь, где лимфоциты и антитела выполняют специфическую роль распознавания и последующей реакции на антиген.
Иммунотоксикология определялась как "дисциплина, изучающая события, которые могут привести к нежелательным эффектам в результате взаимодействия ксенобиотиков с иммунной системой. Эти нежелательные явления могут вызвать последствия (1) прямого и/или косвенного эффекта ксенобиотиков (и/или продуктов его биотрансформации) на иммунную систему, или (2) иммунологически основанную ответную реакцию на соединение и/или его метаболит (ы) либо антигены хозяина, измененные данным соединением или его метаболитами" (Berlin et al. 1987).
В случае, если иммунная система выступает в качестве пассивной мишени для химических веществ, результатом может быть пониженная сопротивляемость инфекции и некоторым формам неоплазии, либо иммунная дисрегуляция/стимуляция, могущие усугубить аллергию или аутоиммунитет. В случае, если иммунная система реагирует на антигенную специфичность ксенобиотика или антиген хозяина, измененные соединением, токсичность может быть выражена в виде аллергии или аутоиммунного заболевания.
Разработаны модели с использованием животных для исследования подавления иммунитета, вызванного химическими веществами, причем достоверность ряда методов подтверждена (Burleson, Munson, and Dean 1995; IPCS 1996). Для целей тестирования используется поэтапный подход, обеспечивающий адекватный выбор из огромного количества имеющихся анализов. В целом, задачей первого этапа является определение потенциальных иммунотоксикантов. Если потенциальные иммунотоксиканты установлены, проводится второй этап анализов для подтверждения и характеризации дальнейших наблюдаемых изменений. Во время третьего этапа непосредственно изучаются механизмы действия соединения. В результате опытов на животных установлено, что ряд ксенобиотиков является иммуноподавителями.
Существует ограниченная база данных о нарушении иммунных функций человека под воздействием химических веществ из окружающей среды (Descotes 1986; NRC Subcommittee on Immunotoxicology 1992). Использование маркеров иммунотоксичности не получило распространения в клинических и эпидемиологических исследованиях воздействия этих химических веществ на здоровье человека. Такие исследования проводились редко, а интерпретация полученных данных не позволяет сделать однозначного вывода вследствие, например, неконтролируемого характера воздействия. Поэтому решения относительно опасности и риска сегодня базируются на оценке иммунотоксичности у грызунов с последующей экстраполяцией на человека.
Реакции гиперчувствительности, в частности, аллергическая астма и контактный дерматит, представляют серьезную проблему охраны труда на производстве в промышленно развитых странах (Vos, Younes and Smith 1995). Явление контактного дерматита было впервые исследовано на морской свинке (Andersen and Maibach 1985). До сегодняшнего дня этот вид животных предпочтительно использовался в опытах с целью прогнозирования. Существуют разнообразные методы тестирования на морских свинках, из них наиболее часто используется тест максимизации и тест Buehler с зарастающей бляшкой. Тесты на морских свинках и новые подходы с использованием мышей, например, тесты на опухолях и локальных лимфатических узлах, обеспечили токсикологов новыми инструментами для оценки опасности сенсибилизации кожи. Ситуация с сенсибилизацией дыхательного тракта резко отличается. Сегодня отсутствуют достаточно обоснованные и широко распространенные методы определения химических аллергенов дыхательных путей, хотя был достигнут определенный прогресс в разработке моделей изучения химической аллергии дыхательных путей на морских свинках и мышах.
Человеческие данные свидетельствуют о том, что химические агенты, в частности, лекарства могут вызывать аутоиммунные заболевания (Kammьller, Bloksma and Seinen 1989). Ряд опытов на животных позволяет моделировать аутоиммунные заболевания. Они охватывают как спонтанную патологию (например, системная красная волчанка на новозеландской черной мыши), так и аутоиммунные явления, вызванные экспериментальной иммунизацией автоантигеном перекрестной реакции (например, артрит, вызванный H37Ra у крыс линии Левис). Эти модели применяются для доклинической оценки иммуноподавляющих лекарств. В очень редких исследованиях рассматривается потенциал этих моделей для оценки роли ксенобиотиков в приобретенном или наследственном аутоиммунитете. Практически отсутствуют модели, основанные на животных, для исследования возможности химических веществ вызывать аутоиммунные заболевания. Одна из моделей, используемая в ограниченном масштабе - это подколенный лимфатический узел у мышей. Как и у человека, у лабораторных животных генетические факторы играют решающую роль в развитии аутоиммунного заболевания (AD), что ограничивает использование этих тестов для прогноза заболевания.
Иммунная система
Главная функция иммунной системы - защита организма от бактерий, вирусов, паразитов, грибов и неопластических клеток. Это обеспечивается благодаря хорошо скоординированным действиям различного вида клеток и их растворимых посредников. Защиту хозяина можно грубо разделить на неспецифическую или врожденную сопротивляемость и специфический или приобретенный иммунитет при посредничестве лимфоцитов (Roitt, Brostoff and Male 1989).
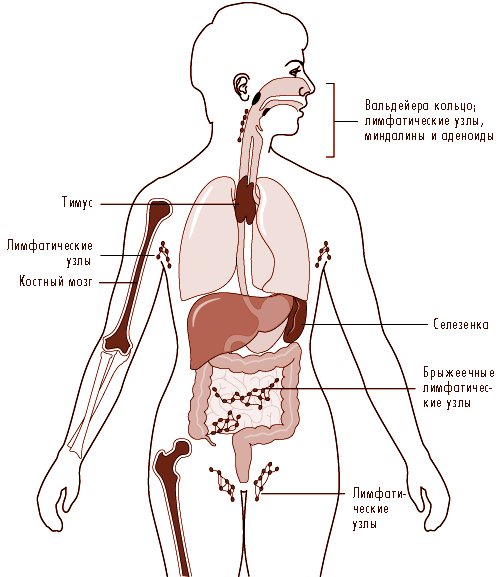
Компоненты иммунной системы присутствуют в различных частях организма (Jones et al. 1990). Компартмент лимфоцита присутствует в лимфатических органах (Рис. 33.14). Костный мозг и тимус классифицируются как первичные или центральные лимфатические органы; вторичные или периферийные лимфатические органы включают лимфатические узлы, селезенку и лимфоидные ткани вдоль секреторной поверхности желудочно-кишечного и дыхательного тракта, так называемые лимфоидные ткани, связанные со слизистой оболочкой (MALT). В них одновременно находится коло половины всех лимфоцитов организма. Кроме того, кожа является важным органом, индуцирующим иммунную реакцию на антигены, присутствующие в коже. Важную роль в этом процессе играет эпидермальные клетки Лангерханса (Langerhans), обладающие антиген-представляющей функцией.
Фагоцитные клетки родословной линии моноцитов/макрофагов, известные как мононуклеарная фагоцитная система (MPS), находятся в лимфатических органах и внеузловых участках; внеузловые фагоциты включают клетки Купфера (Kupffer) в печени, альвеолярных макрофагах в легких, мезангиальных макрофагах в почках и глиальных клетках мозга. Полиморфноядерные лейкоциты (PMN) присутствуют, главным образом, в мозге и костном мозге, но аккумулируются в участках воспаления.
--------------------------------------------------------------------------------
Рис. 33.14 Первичные и вторичные лимфоидные органы и ткани

--------------------------------------------------------------------------------
Неспецифическая защита
Первая линия защиты от микроорганизмов осуществляется такими физическими и химическими барьерами как кожа, дыхательный и пищеварительный тракт. Эти барьеры укрепляется неспецифическими защитными механизмами, включая клетки фагоцитов, такие как макрофаги и полиморфноядерные лейкоциты, способные убивать патогены, а также природные "клетки-убийцы", способные лизировать опухолевые клетки и клетки, зараженные вирусом. Комплементная система и некоторые ингибиторы микробов (например, лизосомы) также участвуют в неспецифической ответной реакции.
Специфический иммунитет
После исходного контакта хозяина с патогеном, индуцируются специфические иммунные реакции. Отличительной чертой этой второй линии обороны является специфическое распознавание детерминантов, так называемых антигенов или эпитопов, патогенов рецепторами на поверхности клетки B- и T-лимфоцитов. После взаимодействия со специфическим антигеном, у клетки, несущей рецептор, стимулируется размножение и дифференциация с образованием клона потомственных клеток, специфичных для возбуждающего антигена. Специфические иммунные реакции помогают создать неспецифическую защиту от патогенов путем стимулирования эффективной неспецифической ответной реакции. Основная характерная черта специфического иммунитета заключается в образовании памяти. Вторичный контакт с одним и тем же антигеном провоцирует более быструю, энергичную и хорошо управляемую ответную реакцию.
Геном человека не обладает способностью переносить коды набора антигенных рецепторов, достаточных для распознавания антигенов, с которыми возможен контакт. Диапазон специфичности развивается в процессе перегруппировки генов. Это беспорядочный процесс, в ходе которого возникают различные виды специфичности. К ним относятся специфичность к собственным компонентам, которые являются нежелательными. Процесс селекции, происходящий в тимусе (Т-клетки) или костном мозге (В клетки), направлен на устранение этих нежелательных видов специфичности.
Нормальная функция иммунного эффектора и гомеостатическая регуляция иммунной реакции зависят от ряда растворимых продуктов, известных как "цитокины", которые синтезируются и выделяются лимфоцитами и другими видами клеток. Цитокины оказывают плейотропный эффект на иммунную и воспалительную реакцию. Для иммунной реакции необходимо взаимодействие различных клеточных популяций - регуляция реакции на антитела, аккумуляция иммунных клеток и молекул в воспалительных участках, начало реакций острой фазы, контроль цитотоксичной функции макрофагов и многие другие процессы, важные для сопротивляемости хозяина. Они находятся под влиянием и даже в зависимости от цитокинов, действующих индивидуально или коллективно.
Общепризнанны две составляющих иммунитета: гуморальный иммунитет и клеточно-опосредованный иммунитет.
Гуморальный иммунитет. В гуморальной части В-лимфоциты стимулируются после распознавания антигена рецепторами клеточной поверхности. Рецепторами антигенов в В-лимфоцитах являются иммуноглобулины (Ig). Зрелые В клетки (плазмациты) начинают производить антиген-специфические иммуноглобулины, выступающие как антитела в сыворотке или вдоль слизистых поверхностей. Известны пять основных классов иммуноглобулинов: (1) IgM, пяти-членный Ig с оптимальной агглютинирующей способностью, образующийся после антигенной стимуляции; (2) IgG, основной Ig в системе кровообращения, способный проникать через плаценту; (3) IgA, секреторный Ig для защиты слизистых поверхностей; (4) IgE, фиксирующий Ig к мастоцитам или базофильным гранулоцитам, участвующим в непосредственных реакциях гиперчувствительности и (5) IgD, которые выполняют функцию рецепторов В-лимфоцитов.
Клеточно-опосредованный иммунитет. Т-лимфоциты являются клеточной составляющей иммунной системы. Эти клетки также имеют на своих мембранах рецепторы антигенов. Они распознают антигены в случае, если они представлены антигенными клетками в контексте гистосопоставимых антигенов. Поэтому эти клетки имеют ограничение в дополнение к антигенной специфичности. Т-клетки действуют как клетки-помощники в различных реакциях (включая гуморальные), осуществляют рекрутинг воспалительных клеток и подобно цитотоксичным Т-клеткам способны убивать клетки-мишени после антиген-специфического распознавания.
Механизмы иммунотоксичности
Иммуносупрессия
Эффективное сопротивление хозяина зависит от функциональной целостности иммунной системы, для чего необходимо, чтобы клетки и молекулы, участвующие в иммунной реакции, находились в достаточном количестве и рабочем состоянии. Врожденный иммунодефицит человека часто характеризуется дефектом отдельных стволовых линий клеток, в результате чего нарушается или прекращается образования иммунных клеток. По аналогии с врожденными и приобретенными заболеваниями иммунодефицита, причиной химически-индуцированной иммуносупрессии может быть пониженное количество функциональных клеток (МПБХВ 1996). Отсутствие или пониженное количество лимфоцитов может оказывать более или менее сильно влиять на иммунный статус. Некоторые состояния иммунодефицита и тяжелая форма иммуносупрессии могут возникать при трансплантации или цитостатической терапии, что связывается, в частности, с повышенной частотой оппортунистических инфекций и некоторых неопластических заболеваний. Инфекции могут иметь бактериальное, вирусное, грибковое или протозойную природу, причем доминирующий вид инфекции зависит от иммунодефицита. Можно ожидать, что воздействие иммуносупрессоров из окружающей среды, вызовет более слабые формы подавления иммунитета, которые трудно обнаружить. Это может привести, например, к повышенной частоте таких инфекций как грипп или обычная простуда.
Поскольку иммунная система имеет сложное строение с участием разнообразных клеток, посредников и функций, образующих сложную и взаимосвязанную сеть, иммунотоксичные соединения обладают различными возможностями вызывать эффект. Хотя характер исходных поражений, индуцируемых различными иммунотоксичными химическими веществами, пока не выяснен, появляются новые данные, полученные, в основном, в результате опытов на лабораторных животных, относительно иммунобилогических изменений, приводящих к подавлению иммунной функции (Dean et al. 1994). Токсические эффекты могут иметь место при следующих критических функциях (также приводятся некоторые примеры иммунотоксичных соединений, влияющих на эти функции):
· развитие и расширение популяций различных стволовых клеток (бензол вызывает иммунотоксические эффекты на уровне стволовых клеток, вызывая лимфоцитопению)
· размножение различных липоидных и миелоидных клеток, а также поддерживающих тканей, где эти клетки созревают и функционируют (иммунотоксичные соединения, органотиновые соединения подавляют быстрое размножение лимфоцитов в коре тимуса путем прямой токсичности; тимотоксическое действие 2,3,7,8-тетрахлоро-дибензо-р-диоксина (TCDD) и смежных соединений, скорее, вызвано нарушенной функцией клетки эпителия тимуса, а не прямой токсичностью тимоцитов)
· поступление, процессинг и презентация антигенов макрофагами и другими антиген-презентирующих клеток (одной из мишеней 7,12-диметилбенол(а)антрацена (DMBA) и свинца является презентация антигенов макрофагами; мишенью ультрафиолетового излучения является антиген-презентирующие клетки Лангерханса (Langerhans)
· регулирующая функция Т-помощников и Т-супрессоров (функция Т-помогающей клетки нарушается органотинами, альдикарбом, полихлорированными бифенилами (ПХБ), TCDD и DMBA; функции T-подавляющей клетки снижаются при лечении малой дозой циклофосфамида)
· образование различных цитокинов или интерлейкинов (бензо(а)пирен (БП) подавляет образование интерлейкина-1; ультрафиолетовое излучение влияет на образование цитокинов через кератиноцит)
· синтез различных классов иммуноглобулинов IgM и IgG подавляется после обработки ПХБ и трибутилиноксидом (TBT), и возрастает после воздействия гексахлорбензола (ГХБ)
· регуляция и активация комплемента (затронутого TCDD)
· цитотоксическая функция Т-клетки (3-метилхолантрен (3-MC), DMBA, и TCDD подавляют активность Т-клетки)
· клеточная функция "природного убийцы" (NK) (легочная NK активность подавляется озоном; селезеночная NK активность нарушается никелем)
· хемотаксис и цитотоксические функции макрофага и полиморфноядерного лейкоцита (озон и диоксид азота нарушают активность фагоцитов альвеолярных макрофагов).
Аллергия
Аллергию можно определить как негативное воздействие на состояние здоровья в результате индукции и проявления специфических иммунных реакций. Термин псевдоаллергия используется, когда реакции гиперчувствительности происходят без участия иммунной системы. В контексте иммунотоксикологии аллергия является результатом специфической иммунной реакции на химические вещества и лекарства, представляющие интерес. Способность химического вещества вызывать сенсибилизацию у отдельных людей обычно связана с его способностью ковалентно связываться с белками в организме. Аллергические реакции могут принимать разнообразные формы, имеющие различные механизмы и скорость реакции. Различаются четыре основные типа аллергических реакций: Тип I - гиперчувствительные реакции, вызываемые антителом IgE, при которых симптомы проявляются через несколько минут после воздействия чувствительного человека. Тип II - гиперчувствительные реакции в результате поражения или разрушения антителом клеток хозяина. В данном случае симптомы проявляются в течение нескольких часов. Тип III - гиперчувствительные реакции или реакции Артуса (Arthus) также вызываются антителом, действующего против растворимого антигена, результатом чего является локальное или системное действие иммунных комплексов. Тип IV или гиперчувствительность замедленного типа, вызванная Т-лимфоцитами, когда симптомы обычно проявляются в течение 24-48 часов после воздействия на чувствительного человека.
Два типа химической аллергии имеют огромное значение для гигиены труда - контактная чувствительность или кожная аллергия и аллергия дыхательного тракта.
Контактная гиперчувствительность. Большое количество химических веществ могут вызывать чувствительность кожи. В результате местного воздействия химического аллергена на чувствительного человека образуется ответная реакция Т-лимфоцитов в дренажных лимфатических узлах. В коже аллерген прямо или косвенно взаимодействует с клетками Лангерханса (Langerhans) в эпидермисе, которые переносят химическое вещество в лимфатические узлы и представляют их в иммуногенной форме реактивным И-лимфоцитам. Аллерген-активированные Т-лимфоциты размножаются, что приводит к клональной экспансии. У человека развивается сенсибилизация и он реагирует на второе кожное воздействие того же химического вещества более агрессивной иммунной реакцией, что приводит к аллергическому контактному дерматиту. Кожная воспалительная реакция, характерная для аллергического контактного дерматита, является следствием распознавания аллергена в коже специфическими Т-лимфоцитами. Эти лимфоциты активизируются, высвобождают цитокины и вызывают локальную аккумуляцию других моноядерных лейкоцитов. Симптомы проявляются в течение 24-48 часов после воздействия на чувствительного человека, следовательно аллергический контактный дерматит является гиперчувствительностью замедленного типа Распространенные причины аллергического контактного дерматита включают органические химические вещества (например, 2,4-динитрохлорбензол), металлы (например, никель и хром) и растительные продукты (например, урушиол ядовитого сумаха (Toxicodendron radicans).
Дыхательная гиперчувствительность. Дыхательная гиперчувствительность обычно рассматривается как реакция гиперчувствительности Типа I. Однако реакции поздней фазы и более хронические симптомы, связанные с астмой, могут включать клеточно опосредованные (Тип IV) иммунные процессы. Острые симптомы, связанные с дыхательной аллергией, вызваны антителом IgE, образование которого провоцируется воздействием чувствительных людей к индуцирующему химическому аллергену. Антитело IgE распределяется системно и связывается через рецепторы мембраны с мастоцитами, находящимися в сосудистых тканях, включая дыхательный тракт. Ингаляция того же химического вещества вызывает реакцию дыхательной гиперчувствительности. Аллерген связывается с белком и поперечно связывается с антителом IgE, связанным с мастоцитом. Это, в свою очередь, вызывает дегранулирование мастоцитов и высвобождает переносчиков воспаления, например, гистамины и лейкотриены. Переносчики вызывают бронхостеноз и расширение кровеносных сосудов, в результате чего появляются симптомы дыхательной аллергии, астмы и/или ринита. Химические вещества, вызывающие у человека дыхательную гиперчувствительность, включают кислотные ангидриды (например, тримеллитический ангидрид), некоторые диизоцианиты (например, диизоцианит толуола), соли платины и некоторые красители с высокой химической активностью. Хроническое воздействие бериллия также вызывает гиперчувствительность легких.
Ауитоиммунная реакция
Аутоиммунная реакция может быть определена как стимуляция специфических иммунных реакций, направленных против "собственных" антигенов эндогенного происхождения. Индуцированные аутоиммунные реакции могут быть вызваны либо изменением баланса регулирующих Т-лимфоцитов, либо соединением ксенобиотика с нормальными компонентами ткани, преобразуя их в иммуногенные ("измененное свое"). Лекарства и химические вещества, в отдельных случаях индуцирующие или усугубляющие такие эффекты как аутоиммунные заболевания (AD) у восприимчивых людей - это соединения с низким молекулярным весом (молекулярный вес от 100 до 500), которые сами по себе не считаются иммуногенными. Механизм АD в результате воздействия химических веществ практически неизвестен. Заболевание может быть вызвано напрямую циркулирующим антителом или косвенно путем образования иммунных комплексов, а также вследствие иммунитета, передаваемого клеткой, но вероятнее всего сочетанием нескольких механизмов. Наиболее изучен патогенез иммунных гемолитических нарушений, вызываемых лекарствами:
· Лекарство может прикрепляться к мембране красного тельца и взаимодействовать с антителом, специфическим для данного лекарства.
· Лекарство может изменять мембрану красного тельца так, что иммунная система распознает клетку как чужеродную.
· Лекарство и специфическое антитело образуют иммунные комплексы, которые прикрепляются к мембране красного тельца и вызывают их поражение.
· Сенсибилизация красных телец вызвана образованием антитела красного тельца.
Установлено, что различные химические вещества и лекарства, особенно последние, индуцируют аутоиммунно-подобные реакции (Kamьller, Bloksma and Seinen 1989). Профессиональное воздействие химических веществ приводит к образованию AD-подобных синдромов. Воздействие мономерного винилхлорида, трихлорэтилена, перхлорэтилена, эпоксидных смол и пыли, содержащей окись кремния, вызывают склеродема-подобные синдромы. Синдром, аналогичный системной красной волчанке (SLE) описан у человека после воздействия гидразина. Воздействие диизоцианата толуола связано с индукцией тромбоцитопенической пурпуры. Тяжелые металлы, например, ртуть, в некоторых случаях связывались с иммунным комплексным гломерулонефритом.
Оценка риска для человека
Оценка иммунного статуса человека основана, главным образом, на анализе содержания в периферийной крови таких гуморальных веществ как иммуноглобулин и хромосомный набор, а также лейкоциты крови для исследования состава и функционирования клеточных субпопуляций. Эти методы, как правило, аналогичны тем, которые используются для исследования гуморального и клеточно-опосредованного иммунитета, а также неспецифической резистентности пациентов с подозреваемыми врожденными заболеваниями иммунодефицита. В эпидемиологических исследованиях (например, популяции, подвергающиеся профессиональным воздействиям) параметры следует выбирать на базе их прогностического значения для человеческих популяций, подтвержденных моделях на животных и биологической основы маркеров (см. Таблицу 33.6). Стратегия скрининга иммунотоксических эффектов после (случайного) воздействия загрязнителей окружающей среды или других токсикантов в большой степени зависит от обстоятельств, таких как ожидаемый иммунодефицит, время с момента воздействия и иммунным статусом, степень воздействия и количество людей, подвергшихся воздействию. Процесс оценки риска иммунотоксичности конкретного ксенобиотика у человека чрезвычайно сложен и иногда невозможен, главным образом из-за присутствия различных смешанных факторов, влияющих на ответную реакцию человека на токсическое повреждение. Это особенно актуально при изучении роли химических веществ в возникновении аутоиммунных заболеваний, где генетический фактор играет решающую роль.
--------------------------------------------------------------------------------
Таблица 33.6 Классификация тестов иммунных маркеров
|
Категория теста |
Характеристика |
Специфические тесты |
|
Базовые-общие |
Индикаторы общего состояния здоровья и статуса органов систем |
Азот мочевины крови, содержание глюкозы в крови и т. д. |
|
Базовые-иммунные |
Общие индикаторы иммунного статуса |
Общий счет кровяных телец |
|
Фокусные/рефлексные |
Индикаторы специфических иммунных функций/событий |
Гистосовместимость генотипа |
|
Исследовательские |
Индикаторы общего или специфических иммунных функций/событий |
Опыты по стимуляции in vitro |
--------------------------------------------------------------------------------
Поскольку необходимые человеческие данные часто отсутствуют, оценка риска иммуносупрессии у человека под воздействием химических веществ в большинстве случаев основана на данных, полученных в опытах на животных. Определение потенциальных иммунотоксичных ксенобиотиков проводится, главным образом, в контролируемых опытах на грызунах. В этом отношении исследования воздействий in vivo представляют оптимальный подход к оценке иммунотоксического потенциала химического вещества. Это вызвано сложной и полифакториальной природой иммунной системы и иммунных реакций. Исследования in vitro имеют все возрастающее значение для выяснения механизмов иммунотоксичности. Кроме того, в результате изучения эффектов соединений с использованием клеток человеческого и животного происхождения могут быть получены данные межвидового сравнения, которые можно использовать при подходе "параллелограмма" подходе для совершенствования оценки риска. Суть этого подхода заключается в том, что при известных данных, составляющих три стороны параллелограмма (опыты in vivo и in vitro на животных и на человеке), легче прогнозировать исход, которому соответствует четвертая сторона параллелограмма, то есть риск у человека.
В случае, если оценка риска химически-индуцированной иммуносупрессии, основывается только на данных опытов на животных, можно использовать подход экстраполяции на человека невыясненных факторов до уровня ненаблюдаемого негативного эффекта (NOAEL). Этот уровень может быть основан на параметрах, полученных на соответствующих моделях, таких как оценка резистентности хозяина и in vivo оценка гиперчувствительности и образования антител. В идеальном случае, эффективность данного подхода к оценке риска должна быть подтверждена исследованиями на человеке. Эти исследования должны сочетать определение и измерение токсиканта, оценку эпидемиологических данных и иммунного статуса.
Для прогнозирования контактной гиперчувствительности можно использовать модели на морских свинках, которые применяются с 1970-х годов. Несмотря на высокую чувствительность и воспроизводимость этих тестов, они имеют ряд недостатков, так как зависят от субъективной оценки; это можно преодолеть, используя более современные и количественные методы, разработанные на мышах. Относительно химически-индуцированной гиперчувствительности в результате ингаляции или приема внутрь аллергенов, тесты следует разрабатывать и оценивать с точки зрения их прогностического значения для человека. Устанавливая уровни безопасного профессионального воздействия потенциальных аллергенов, необходимо учитывать двухфазный характер аллергии: фаза сенсибилизации и фаза возбуждения. Концентрация, необходимая для возбуждения аллергической реакции у людей с предыдущей сенсибилизацией значительно ниже, чем концентрация, необходимая для индуцирования сенсибилизации у нормального, но чувствительного человека.
Модели с использованием животных для прогноза химически-индуцированной аутоиммунной реакции практически отсутствуют, поэтому следует уделять особое внимание их разработке. Для разработки таких моделей необходимо углублять наши знания о химически-индуцированных аутоиммунных реакциях человека, включая исследования маркеров иммунной системы для определения чувствительных людей. В качестве объекта исследований можно изучать людей, у которых аутоиммунные реакции вызваны воздействием лекарств.